Der Einfluss der regulatorischen PKA-U L-Typ Kalziumkanäle linksventrikulärer Kardiomyozyten im gesunden und hypertrophen Herz - Opus4
←
→
Transkription von Seiteninhalten
Wenn Ihr Browser die Seite nicht korrekt rendert, bitte, lesen Sie den Inhalt der Seite unten
Der Einfluss der regulatorischen PKA-U e e e RI a f L-Typ Kalziumkanäle linksventrikulärer Kardiomyozyten im gesunden und hypertrophen Herz Institut für Experimentelle und Klinische Pharmakologie und Toxikologie Der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg zur Erlangung des Doktorgrades Dr. med. vorgelegt von Florian Heinlein
Als Dissertation genehmigt von der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Vorsitzender des Promotionsorgans: Prof. Dr. Markus F. Neurath Gutachter: Prof. Dr. Andreas Ludwig Gutachter: Prof. Dr. Andreas Hess Tag der mündlichen Prüfung: 09. Januar 2023
Inhaltsverzeichnis i Inhaltsverzeichnis Inhaltsverzeichnis ..................................................................................................... i Abstract ..................................................................................................................... 1 Zusammenfassung ................................................................................................... 3 1 Einleitung........................................................................................................... 5 1.1 Der -adrenerge Signalweg im Herzen ...................................................... 5 1.2 Die Proteinkinase A ................................................................................... 6 1.2.1 Struktur .................................................................................................. 6 1.2.2 cAMP-abhängige Aktivierung der PKA .................................................. 7 1.2.3 Expressionsmuster ................................................................................ 8 1.2.4 Subzelluläre Lokalisation ....................................................................... 8 1.2.5 Inhibition der PKA .................................................................................. 9 1.3 Der kardiale L-Typ Kalziumkanal ............................................................... 9 1.3.1 Struktur ................................................................................................ 10 1.3.2 Elektrophysiologische Eigenschaften .................................................. 12 1.3.3 -adrenerge Modulation ....................................................................... 13 1.4 Die elektromechanische Kopplung........................................................... 14 1.5 Pathophysiologische Aspekte .................................................................. 16 1.5.1 Herzhypertrophie ................................................................................. 16 1.5.2 -adrenerges Signaling im hypertrophen Herz .................................... 17 1.5.3 L-Typ Kalziumkanäle im hypertrophen Herz ........................................ 18 1.6 Ziele dieser Arbeit .................................................................................... 19 2 Material und Methoden ................................................................................... 20 2.1 Maus-Genotypisierung ............................................................................. 20 2.1.1 Isolation von genomischer DNA........................................................... 20 2.1.1.1 Puffer ........................................................................................... 20 2.1.2 Polymerase-Kettenreaktion.................................................................. 21 2.1.2.1 Primer .......................................................................................... 21
Inhaltsverzeichnis ii 2.1.2.2 Durchführung............................................................................... 22 2.1.3 Agarose-Gelelektrophorese ................................................................. 22 2.1.3.1 Durchführung............................................................................... 23 2.2 Kardiomyozytenisolation nach Langendorff ............................................. 24 2.2.1 Versuchsaufbau und Durchführung ..................................................... 24 2.2.2 Verwendete Lösungen ......................................................................... 27 2.3 Patch-Clamp-Technik .............................................................................. 29 2.3.1 Versuchsaufbau und Durchführung ..................................................... 30 2.3.1.1 Messung von L-Typ Kalziumströmen .......................................... 31 2.3.2 Pipetten ............................................................................................... 33 2.3.3 Verwendete Lösungen ......................................................................... 33 2.3.4 Auswertung der Kalziumströme ........................................................... 34 2.4 Pharmakologische Induktion einer Herzhypertrophie............................... 36 2.5 Elektrokardiographische Untersuchung ................................................... 38 2.6 Ermittlung des Herzgewicht-Körpergewichtsverhältnisses ....................... 38 2.7 Versuchstiere ........................................................................................... 39 2.7.1 Tierhaltung ........................................................................................... 39 2.7.2 Cre-loxP-System.................................................................................. 39 2.7.3 Eingesetztes Mausmodell .................................................................... 40 2.7.4 Zuchtschema ....................................................................................... 41 2.8 Tamoxifenzubereitung und Cre-Induktion ................................................ 42 2.9 Statistische Auswertung ........................................................................... 42 3 Ergebnisse....................................................................................................... 43 3.1 L-Typ Kalziumströme PKA-inhibierter, gesunder Kardiomyozyten .......... 43 3.1.1 Kapazität .............................................................................................. 43 3.1.2 Stromstärke und Stromdichte .............................................................. 44 3.1.3 Leitfähigkeit und Aktivierungsparameter .............................................. 45 3.2 L-Typ Kalziumströme PKA-inhibierter Kardiomyozyten bei Herz- hypertrophie ............................................................................................. 46
Inhaltsverzeichnis iii 3.2.1 Analyse der Herzhypertrophie nach IPE-Stimulation ........................... 47 3.2.1.1 Elektrokardiographie ................................................................... 47 3.2.1.2 Herzgewicht-Körpergewichtsverhältnis ....................................... 48 3.2.2 Kapazität .............................................................................................. 49 3.2.3 Stromstärke ......................................................................................... 50 3.2.4 Stromdichte.......................................................................................... 52 3.2.5 Leitfähigkeit.......................................................................................... 53 3.2.6 Aktivierungsparameter ......................................................................... 53 4 Diskussion ....................................................................................................... 56 4.1 Einfluss der RI auf L-Typ Kalziumkanäle gesunder Kardiomyozyten ..... 56 4.2 Einfl sse der RI -Untereinheit im IPE-Hypertrophiemodell ..................... 57 4.2.1 Einfluss der RI B-Mutation auf zelluläre Hypertrophie ........................ 58 4.2.2 RI B-Mutation redu iert chronotrope Effekte der -adrenergen Stimulation ........................................................................................... 59 4.2.3 Einfluss der RI -Untereinheit auf L-Typ Kalziumströme im IPE- Hypertrophiemodell ............................................................................. 59 4.2.3.1 Indirekte Einfl sse der RI -Untereinheit auf L-Typ Kalziumströme ............................................................................ 61 4.3 Fazit ......................................................................................................... 65 5 Literaturverzeichnis ........................................................................................ 66 6 Anhang.............................................................................................................. iv 6.1 Abkürzungsverzeichnis .............................................................................. iv 6.2 Abbildungsverzeichnis .............................................................................. vii 6.3 Formelverzeichnis .................................................................................... viii 6.4 Tabellenverzeichnis ................................................................................. viii 7 Danksagung ..................................................................................................... ix
Abstract 1 Abstract Objectives L-Type calcium channels play a crucial role in cardiac excitation-contraction coupling. -adrenergic signaling involving protein kinase A (PKA) as a central actor modulates these channels in various ways. However, despite intensive research, the exact role of PKA on L-type calcium channels during -adrenergic stimulation is still unclear. In this work, the influence of the regulatory PKA subunit RI on L-type calcium channels under physiologic conditions and in cardiac hypertrophy is investigated. Design and Methods The Cre-loxP-system was used to generate a mouse line expressing a tamoxifen-in- ducible mutation of the PKA subunit RI (RI B) in the heart. Cardiac hypertrophy was achieved by continuous stimulation of the adrenergic system with isoproterenol and phenylephrine (IPE). Cardiomyocytes were isolated using the Langendorff-perfusion method. L-Type calcium channels from hypertrophied and non-hypertrophied ventric- ular myocytes were examined by analyzing calcium currents using the whole-cell patch-clamp-technique. Observations and Results Under basal conditions, the RI B-mutation did not affect the amplitude or activation characteristics of L-type calcium currents. Continuous adrenergic stimulation led to in- creased heart weight to body weight ratio and heart rate in control (PKA_Ctrl) and RI B (PKA_Mut) animals. Positive chronotropy was significant lower in RI B animals. Cells from IPE treated mutant mice showed no increase in cell capacitance, but significantly increased L-type calcium currents, current density and conductance compared to cells from control animals under IPE stimulation. Voltage dependent activation of L-type calcium current was shifted towards more positive potentials in IPE stimulated control cells, whereas it was slightly shifted to negative potentials in RI B cells under adren- ergic stimulation. Conclusions During -adrenergic stimulation, RI -mediated PKA activity is involved in positive chro- notropy and the development of cellular hypertrophy. RI -controlled PKA activity does
Abstract 2 not directly affect modulation of cardiac L-type calcium channels under basal condi- tions or during chronic -adrenergic stimulation. However, during sustained -adren- ergic stimulation, it affects the -AR/cAMP/PKA signaling cascade in an inhibitory man- ner. Inhibition of the RI subunit consequently results in enhanced activation of L-type calcium channels, presumably resulting in improved cell contractility in the hypertrophic heart.
Zusammenfassung 3 Zusammenfassung Hintergrund und Ziele L-Typ Kalziumkanäle spielen im Rahmen der elektromechanischen Kopplung des Her- zens eine zentrale Rolle. Durch -adrenerge / Proteinkinase A (PKA) -vermittelte Sig- nalwege werden die Kanäle vielfältig moduliert. Trotz intensiver Forschung ist der ge- naue Einfluss der PKA auf L-Typ Kalziumkanäle nach -adrenerger Stimulation immer noch unklar. In dieser Arbeit soll der Einfluss der regulatorischen PKA-Untereinheit RI auf L-Typ Kalziumkanäle sowohl unter physiologischen Bedingungen als auch bei Herzhypertrophie untersucht werden. Methoden Mit dem Cre-loxP-System wurde eine transgene Mauslinie generiert, welche eine Tamoxifen-induzierbare Mutation der RI -Untereinheit (RI B) der kardialen PKA auf- weist. Die Induktion einer Herzhypertrophie erfolgte durch chronische Stimulation des adrenergen Systems mittels Isoprenalin und Phenylephrin (IPE). Herzmuskelzellen wurden mit der Kardiomyozytenisolation nach Langendorff isoliert. L-Typ Kalziumka- näle von hypertrophen und gesunden Herzmuskelzellen wurden durch Messung und Analyse von Kalziumströmen mit der Whole-Cell Patch-Clamp-Technik untersucht. Ergebnisse und Beobachtungen Unter physiologischen Bedingungen hatte die RI B-Mutation weder auf die Kapazität der Zellen noch auf die Stromstärke und Aktivierungsparameter des L-Typ Kalzium- stroms einen signifikanten Einfluss. Die IPE-Stimulation führte bei PKA-inhibierten (PKA_Mut) und Kontrolltieren (PKA_Ctrl) zu einer Zunahme des Herzgewicht-Körper- gewichtsverhältnisses und der Herzfrequenz. PKA_Mut Tiere zeigten jedoch eine sig- nifikant geringere positive Chronotropie. Zellen von PKA_Mut IPE Tieren zeigten ge- genüber jenen von PKA_Ctrl IPE Tieren keine vergrößerte Kapazität, jedoch eine sig- nifikante Zunahme von L-Typ Kalziumstromstärke und -dichte sowie Leitfähigkeit. Die Aktivierungsparameter der L-Typ Kalziumströme waren bei PKA_Ctrl IPE Zellen zu positiveren Potentialen verschoben. Demgegenüber waren sie bei Zellen der PKA_Mut IPE Gruppe zu negativeren Werten verschoben.
Zusammenfassung 4 Schlussfolgerungen und Diskussion Im Rahmen der -adrenergen Stimulation ist die RI -vermittelte PKA-Aktivität an der positiven Chronotropie und der Entwicklung einer zellulären Hypertrophie beteiligt. Die RI -assoziierte PKA-Aktivität hat unter basalen Bedingungen und während chro- nischer -adrenerger Stimulation keinen direkten Einfluss auf die Modulation von kar- dialen L-Typ Kalziumkanälen. Jedoch beeinflusst sie während anhaltender -adrener- ger Stimulation die -AR/cAMP/PKA-Signalkaskade in hemmender Art und Weise. Durch die Inhibition der RI -Untereinheit ergibt sich folglich eine verstärkte Aktivierung von L-Typ Kalziumkanälen, woraus vermutlich eine verbesserte Kontraktilität der Zel- len im hypertrophen Herzen resultiert.
Einleitung 5 1 Einleitung Das Herz ist das zentrale Organ des Blutkreislaufs. Die Gewährleistung einer an die Kreislaufbedingungen angepassten Pumpfunktion erfordert eine fein koordinierte Ab- folge aus Kontraktion und Relaxation einzelner Herzmuskelzellen (Schrader et al. 2014). Hierbei spielt Kalzium eine grundlegende Rolle. Als zweiwertiges Ion (Ca 2+) gelangt es während des Aktionspotentials durch spannungsabhängige Kalziumkanäle in die Zelle. Hier induziert es die weitere Freisetzung von Kalzium aus dem Sarkoplas- matischen Retikulum und interagiert mit Proteinen des Sarkomers, um die Kontraktion der Muskelzelle auszulösen (Catterall 2000, Bers 2002). Weiterhin beeinflussen Kalzi- umionen als second Messenger zelluläre Signalwege und sind an der Regulation von Genexpression und Zellwachstum, des Energiestoffwechsel sowie Zelltod beteiligt (Bers 2008, Dominguez-Rodriguez et al. 2012). 1.1 Der -adrenerge Signalweg im Herzen Um den hämodynamischen Anforderungen des Körpers in verschiedenen Situationen gerecht zu werden, unterliegen die kontraktilen Prozesse des Herzens der Kontrolle des autonomen Nervensystems (ANS). Während der sympatho-adrenerge Teil des ANS (Sympathikus) eine Erhöhung der Leistungsfähigkeit des Herzens vermittelt ( fight or flight Reaktion ), hat dessen Gegenspieler, der cholinerge Parasympathikus, einen hemmenden Einfluss auf die Her leistung ( rest and digest Reaktion , Schrader et al 2014). Die Katecholamine Adrenalin und Noradrenalin sind die wichtigsten Botenstoffe des Sympathikus. Ihre Wirkung am Herzen entfalten sie überwiegend durch die Aktivierung von -Adrenorezeptoren, welche zur Familie der G-Protein-gekoppelten Rezeptoren (GPCR) zählen (Rockman et al. 2002). Die von Kardiomyo yten exprimierten -Re- eptoren k nnen in die Subtypen 1, 2 und 3 eingeteilt werden, wobei 1-Rezeptoren mit 75 % den größten Anteil ausmachen. Auf die 2- und 3-Rezeptoren entfallen unter physiologischen Bedingungen jeweils 17 % bzw. 3 % (Brodde 1993, Lymperopoulos et al. 2013). Es wird jedoch vermutet, dass nur ein geringer Anteil von Kardiomyozyten 2- und 3-Rezeptoren exprimiert, wohingegen der 1-Subtyp in allen Herzmuskelzel- len vorkommt (Myagmar et al. 2017).
Einleitung 6 -Rezeptoren sind an G s-Proteine gekoppelt, welche die membranständige Ade- nylylcyclase (AC) aktivieren (Salazar et al. 2007). Diese katalysiert die Bildung von zyklischem Adenosin-3 ,5 -monophosphat (cAMP), welches weitere Signalwege akti- viert. Hierzu zählen insbesondere die Aktivierung der Proteinkinase A (PKA). Die PKA phosphoryliert verschiedene Zielproteine und moduliert so deren Aktivität (Liu et al. 2021). 2-Rezeptoren können neben G S auch G i-Proteine binden und so als Gegen- spieler die Adenylylcyclase hemmen und die cAMP-vermittelte PKA-Aktivierung ver- ringern (Xiao 2001). Zusammengefasst werden durch den -adrenergen Signalweg die Herzfrequenz (po- sitive Chronotropie), die Geschwindigkeit der Erregungsleitung (positive Dromotropie), die Kontraktilität der Herzens (positive Inotropie) und die Geschwindigkeit der Relaxa- tion (positive Lusitropie) gesteigert und somit die kardiale Auswurfleistung und das Herzzeitvolumen erhöht (Lymperopoulos et al. 2013). Zudem spielt eine dauerhafte - adrenerge Stimulation des Herzens eine wichtige Rolle bei der Entstehung von Herz- hypertrophie und Herzinsuffizienz (Communal et al. 1999, Engelhardt et al. 1999, Morisco et al. 2001, Osadchii et al. 2007). 1.2 Die Proteinkinase A Die Proteinkinase A (PKA) ist ein Enzym aus der Familie der cAMP-abhängigen Serin- Threonin-Kinasen. Im Rahmen der Signaltransduktion phosphoryliert sie ver- schiedenste zytosolische und nukleäre Zielproteine und reguliert so deren Aktivität. W hrend der -adrenergen Stimulation im Herz zählen hierzu unter anderem kontrak- tile Proteine wie Troponin I und Myosin-bindendes Protein C3, Transkriptionsfaktoren wie CREB, Ionenkanäle wie der L-Typ Kalziumkanal-Proteinkomplex und der Rya- nodin-2 Rezeptor sowie regulatorische Proteine wie Phospholamban oder G-Protein- gekoppelte Rezeptor-Kinasen (Bers 2008, Lymperopoulos et al. 2013, Liu et al. 2021). 1.2.1 Struktur Im inaktiven Zustand liegt die PKA als Tetramer, bestehend aus jeweils zwei regulato- rischen und katalytischen Untereinheiten, vor (R2C2). Über eine N-terminale Dimerisie- rungsdomäne interagieren die beiden regulatorischen Untereinheiten miteinander und
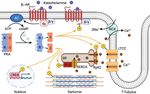
Einleitung 7 mit verschiedenen Ankerproteinen (Gold et al. 2006). Eine Autoinhibierungsdomäne vermittelt die Interaktion und Inhibition der katalytischen Untereinheiten. Am C-termi- nalen Ende der regulatorischen Untereinheiten befinden sich zwei Bindungsdomänen für cAMP (Bindungsstelle A und B). Die katalytische Untereinheit besitzt N-terminal eine ATP-Bindungsregion und C-terminale Domänen für die Substratbindung, kataly- tische Aktivität und Interaktion mit der regulatorischen Untereinheit. (Scott 1991, Skalhegg und Tasken 2000, Taylor et al. 2012). Abbildung 1: Aufbau und Aktivierung der PKA A, B Struktur der regulatorischen (A) und katalytischen Untereinheit (B) der PKA. C Schematische Darstellung der Aktivierung der PKA. Die Bindung von cAMP an die regulatorischen Untereinheiten bewirkt eine Konformati- onsänderung und das Abdissoziieren der katalytischen Untereinheiten aus dem Holoenzym. Die katalytischen Untereinheiten sind als Monomere in der Lage, Zielproteine zu phosphorylieren. AID: Autoinhibierungsdomäne, C: katalytische Untereinheit, CNBA/CNBB: cAMP Bindungsstelle A/B, D/D: Dimerisierungs- und Docking-Do- mäne, R: regulatorische Untereinheit, UE: Untereinheit. Angelehnt an Skalhegg und Tasken (2000) und Taylor et al. (2012). Abbildung erstellt mit BioRender.com 1.2.2 cAMP-abhängige Aktivierung der PKA Bindet cAMP an die entsprechenden Bindungsstellen der regulatorischen Untereinhei- ten ändert sich deren Konformation, ihre Affinität zu den katalytischen Untereinheiten nimmt ab und die katalytischen Untereinheiten dissoziieren aus dem Holoenzym
Einleitung 8 (R2C2 + 4 cAMP (R2 + 4 cAMP) + C1 + C1). Die aktiven katalytischen Monomere können nun Zielproteine phosphorylieren, indem sie die -Phosphatgruppe von ATP auf Serin- und Threonin-Reste dieser übertragen (Scott 1991, Skalhegg und Tasken 2000, Taylor et al. 2012). Durch G i-gekoppelte Rezeptoren kann die Adenylylcyclase und somit auch die cAMP-vermittelte PKA-Aktivierung gehemmt werden (Chen und Iyengar 1993). Au- ßerdem spalten Phosphodiesterasen (PDEs) cAMP in Adenosin-5 -monophosphat (AMP) und können so ebenfalls die Aktivierung der PKA verringern und Signalwege beenden (Wang et al. 2015, Ercu und Klussmann 2018). 1.2.3 Expressionsmuster Eine cAMP-vermittelte PKA-Aktivierung kann durch verschiede G s-Protein-gekop- pelte Rezeptoren erfolgen (Zaccolo 2009, Wang et al. 2018). Um die Signaldiversität einer Zelle zu gewährleisten und verschiedene Signalwege räumlich und zeitlich zu trennen, unterliegen die verschiedenen PKA-Untereinheiten einerseits einer ge- websabhängigen Expression und andererseits einer vom Signalweg abhängigen, sub- zellulären Lokalisation (Taylor et al. 2012). Das menschliche Genom kodiert drei Isoformen der katalytischen Untereinheit (C , C , C ). M use weisen nur die C und C Isoformen auf, welche ubiquitär exprimiert werden (Kirschner et al. 2009). Im humanen und murinen Genom kodieren vier Gene f r die Isoformen RI , RI , RII und RII der regulatorischen Untereinheit. W hrend die -Untereinheiten ubiquitär vorkommen, wird die RI Untereinheit ausschlie lich im Nerven- und Fettgewebe exprimiert. Die Expression von RII ist auf Zellen von Lunge, Nerven- und Fettgewebe sowie Reproduktions- und neuroendokrine Organe be- schränkt (Skalhegg und Tasken 2000, Kirschner et al. 2009). 1.2.4 Subzelluläre Lokalisation Weiter unterscheidet sich die zelluläre Lokalisation der Isoformen. Typ I Untereinheiten (RI , RI ) liegen vorwiegend ytosolisch f r globale Phosphorylierungen vor (Taylor et al. 2012). Typ II Isoformen (RII und RII ) sind ber A-Kinase Ankerproteine (AKAPs) an subzelluläre Strukturen gebunden. Diese Ankerproteine interagieren mit weiteren
Einleitung 9 Proteinen wie G-Protein-gekoppelten Rezeptoren, Rezeptorkinasen (GRKs), Adenylyl- cyclasen, Ionenkanälen und Phosphodiesterasen (Taylor et al. 2012, Ercu und Klussmann 2018). So können Signalwege, die durch GPCR, Adenylylcyclasen und cAMP aktiviert werden, durch die abgestimmte, simultane Aktivierung von PDEs und GRKs im Sinne eines negativen Feedback-Loops wieder inaktiviert werden. Auf diese Weise bilden AKAPs das R ckgrat f r Signalinseln , welche abhängig vom jeweiligen Signal zeitlich und räumlich exakt koordinierte Reaktionen ermöglichen (Zaccolo 2009, Xiang 2011, Smith et al. 2017, Ercu und Klussmann 2018). 1.2.5 Inhibition der PKA Neben der Inhibierung der katalytischen Aktivität durch die regulatorischen Unterein- heiten können die katalytischen Untereinheiten physiologischer Weise auch durch ein PKA-Inhibitor Peptid (PKI) gehemmt werden (Liu et al. 2020a). Zur Untersuchung ihrer Funktion kann die PKA auf verschiedene Wege in vitro und in vivo inhibiert werden. Hier spielen insbesondere pharmakologische Methoden, wie die in vitro Zugabe von synthetischen PKA-Inhibitoren wie H89 oder PKI-Analoga eine Rolle (Murray 2008). Eine umfassende, organspezifische Inhibition der PKA in vivo kann z.B. durch gewebs- spezifische Überexpression des endogenen PKI erfolgen (Zhang et al. 2013, Zhang et al. 2019). Durch Mutation der regulatorischen Untereinheiten kann die cAMP-vermit- telte PKA-Aktivierung verhindert und so ihre Gesamtaktivität reduziert werden. Auf diese Weise kann die Funktion der verschiedenen regulatorischen Untereinheiten ana- lysiert werden (Willis et al. 2011). In dieser Arbeit wurde ein Mausmodell mit einer herzspezifischen, dominant-negativen Mutation der RI -Untereinheit verwendet (Jamra 2018). 1.3 Der kardiale L-Typ Kalziumkanal Kardiale L-Typ Kalziumkanäle zählen zu den spannungsabhängigen Ionenkanälen. Ihnen kommt während der elektromechanischen Kopplung eine zentrale Rolle zu (Bers 2002). Sie werden durch Depolarisation der Zellmembran aktiviert und ermöglichen den Einstrom von Kalziumionen (Ca2+) in die Zelle. Dieser Ionenstrom (Einwärtsstrom) kann als Kalziumstrom (ICa-L) gemessen werden (Reuter 1967, Catterall 2011).
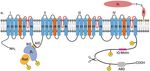
Einleitung 10 Abhängig von ihrem molekularen Aufbau, den elektrophysiologischen Eigenschaften und der Sensitivität gegenüber blockierenden Substanzen können die Kanäle anhand ihrer 1-Untereinheit in verschiedene Klassen und Unterfamilien eingeteilt werden (Catterall et al. 2005). Der im Herzmuskel exprimierte L-Typ Kalziumkanal (LTCC, CaV 1.2) zeichnet sich durch eine schnelle Aktivierung und vergleichsweise langsame In- aktivierung (long lasting, L-Typ) sowie Sensitivität gegenüber klassischen Kalziumka- nalblockern wie Dihydropyridinen, Phenylalkylaminen und Benzothiazepinen aus (Reuter et al. 1988, Catterall et al. 2005, Lacinova 2005). 1.3.1 Struktur Der kardiale L-Typ Kalziumkanal ist ein Proteinkomplex bestehend aus drei Unterein- heiten. Eine die Zellmembran durchspannende CaV 1C-Untereinheit wird von einer intra ellul ren -Untereinheit und einer berwiegend extra ellul ren 2 -Untereinheit begleitet (Kumari et al. 2018). Die 1C-Untereinheit (auch CaV 1.2-Untereinheit) formt die Kanalpore in der Zellmem- bran. Sie setzt sich, wie bei allen spannungsabhängigen Kalziumkanälen, aus vier ver- bundenen, homologen Domänen (I-IV) mit jeweils sechs -helikalen Transmembran- segmenten (S1-S6) zusammen. Eine Schleife (Loop) zwischen den Segmenten S5 und S6 jeder Domäne dient als Selektivitätsfilter, sodass der Kanal nur für Kalziumio- nen passierbar ist. Die S4-Segmente bilden einen Spannungssensor. Sie enthalten positiv geladene Aminosäuren und werden durch Depolarisation der Zellmembran phy- sisch verschoben , sodass die Kanalpore geöffnet wird (Bodi et al. 2005, Catterall 2011). Der distale C-Terminus liegt in proteolytisch geschnittener Form, nicht kovalent gebunden mit der restlichen 1C-Untereinheit vor und fungiert als eine Autoinhibie- rungsdomäne, die die Aktivität des Kanals reduziert. Der C-Terminus enthält weiter Bindungsstellen für AKAPs, Calmodulin und andere regulatorische Proteine. (Hulme et al. 2006, Catterall 2011, Oz et al. 2017). Von den vier bekannten CaV -Untereinheiten ( 1- 4) wird haupts chlich die 2-Iso- from im Herzmuskel exprimiert (Ludwig et al. 1997, Link et al. 2009). Sie ist über eine Interaktionsdomäne ( -Interaktionsdomäne, BID) an das Verbindungselement zwi- schen den ersten beiden Dom nen der 1C-Untereinheit gebunden (Bodi et al. 2005). Die 2-Untereinheit beeinflusst die Aktivität des L-Typ Kalziumkanals positiv, ist an
Einleitung 11 seiner -adrenergen Modulation beteiligt und hat Einfluss auf seine Lokalisation sowie die korrekte Expression in der Zellmembran (Benitah et al. 2010, Yang et al. 2019, Westhoff und Dixon 2021). Die CaV 2 -Untereinheit besteht aus einer mittels GPI-Anker in der Membran gebun- denen -Untereinheit, welche ber eine Disulfidbr cke an die extra ellul re 2-Un- tereinheit gebunden ist. Sie vermittelt ebenfalls die korrekte Membranlokalisation des CaV 1.2 Kanalkomplexes und beeinflusst dessen Aktivierungsparameter, sodass der Kanal bei kleineren (negativeren) Membranpotentialen aktiviert werden kann (Savalli et al. 2016, Westhoff und Dixon 2021). Abbildung 2: Modellhafte Darstellung des kardialen L-Typ Kalziumkanals Die vier homologen Domänen (I-IV) der 1C-Untereinheit bilden mit je sechs Segmenten (S1-S6) die Pore des CaV 1.2. Das Segment S4 fungiert als Spannungssensor. Die Schleife zwischen S5 und S6 (rot) bildet den Selek- tivitätsfilter. Der C-Terminus der 1C-Untereinheit besitzt Bindungsmotive für regulatorische Proteine, wie das IQ- Motiv für die Bindung von Calmodulin. Außerdem enthält er Bindedomänen für AKAPs (ABD). Der proteolytisch geschnittene distale C-Terminus liegt nicht kovalent gebunden mit dem Kanalkomplex vor (Schere). Über ihre - Interaktionsdomäne (BID) ist die -Untereinheit an die -Interaktionsdomäne (AID) zwischen den ersten beiden Transmembrandomänen (I und II) der 1C-Untereinheit gebunden. Das Rad-Protein interagiert mit der -Unterein- heit und inhibiert den Kanal. Es ist vermutlich an der PKA-vermittelten Modulation des Kanals beteiligt. Die -Un- tereinheit ist durch einen GPI-Anker in der Zellmembran verankert und über eine Disulfidbrücke an die extrazellu- l re 2-Untereinheit gebunden. Exemplarisch sind in Gelb mögliche Phosphorylierungsstellen der PKA dargestellt. Angelehnt an Pallien und Klussmann (2020) und Westhoff und Dixon (2021). Abbildung erstellt mit BioRen- der.com
Einleitung 12 1.3.2 Elektrophysiologische Eigenschaften Die Aktivierungsschwelle des LTCC liegt bei Potentialen positiver -40 mV. Die maxi- male Stromstärke kann zwischen 0 mV und +10 mV registriert werden. Das Umkehr- potential des CaV 1.2 vermittelten Kalziumstroms liegt bei +60 mV bis +70 mV. (Kumari et al. 2018). Bei einem Membranpotential von -80 mV sind die L-Typ Kalziumkanäle geschlossen. Die durch ein Aktionspotential vermittelte Depolarisation führt zu einer Konformations nderung der porenformenden 1C-Untereinheit und Öffnung des Ka- nals, sodass Kalziumionen durch die Kanalpore fließen können. Nach Öffnen des LTCC kommt es durch Kalzium- und Depolarisations-abhängige Vor- gänge zur Inaktivierung des Kanals. Erst nach stattgefundener Repolarisation ist eine erneute Aktivierung möglich (Catterall 2000, Neumaier et al. 2015). Die Kalzium-ab- hängige Inaktivierung (CDI, calcium-dependent-inactivation) wird durch das Kalzium- bindende Protein Calmodulin (CaM) vermittelt und dient als negatives Feedback der Begrenzung des Kalziumeinstroms in die Zelle und der Kalziumfreisetzung aus dem sarkoplasmatischen Retikulum (Richard et al. 2006). Calmodulin interagiert hierbei mit einem Isoleucin-Glutamin-Aminosäuremotiv (IQ-Motiv) des C-Terminus der 1-Un- tereinheit. Durch die Bindung von Kalzium an Calmodulin ändert sich dessen Konfor- mation, wodurch die Kanalpore verschlossen und der Kanal inaktiviert wird (Zuhlke et al. 1999, Catterall 2000). Es wird vermutet, dass die PKA durch Phosphorylierung des C-Terminus die Affinität von Calmodulin zu seiner Bindungsstelle reduziert, wodurch die Inaktivierung des LTCC gehemmt wird (Lei et al. 2018, Pallien und Klussmann 2020). Die spannungsabhängige Inaktivierung (VDI, voltage dependent inactivation) erfolgt später als die CDI und soll eine vorzeitige, erneute Aktivierung des LTCC während der Repolarisation verhindern (Richard et al. 2006). Der genaue Mechanismus ist jedoch unklar. Man vermutet, dass die intrazelluläre Verbindungsschleife zwischen den ersten beiden homologen Domänen der 1C-Untereinheit die Kanalpore spannungsabhängig blockiert. Auch die Beteiligung der - und der 2 -Untereinheit werden diskutiert (Neumaier et al. 2015).
Einleitung 13 1.3.3 -adrenerge Modulation Bereits früh nach der Erstbeschreibung des L-Typ Kalziumkanals und dessen Strömen konnte gezeigt werden, dass diese durch den -adrenergen/cAMP/PKA-Signalweg moduliert werden (Reuter 1967 und 1974, Tsien 1973, Osterrieder et al. 1982). Eine -adrenerge Stimulation führt zu einer erhöhten Öffnungswahrscheinlichkeit der ein- zelnen Kanäle, einer Aktivierung bei negativeren Potentialen und einem größeren Kal- ziumstrom (ICa-L). Aus dem somit verstärkten Kalziumeinstrom in die Zelle resultiert eine gesteigerte Kontraktilität. (Catterall 2015, Kumari et al. 2018). Der genaue Me- chanismus hinter dieser Modulation ist jedoch nach wie vor nicht abschließend geklärt. Lange wurde vermutet, dass PKA-vermittelte Phosphorylierungen der 1C-Untereinheit die Aktivität des Kanals erhöhen würden. Durch Mutation der entsprechenden Serin- und Threonin-Reste der 1C-Untereinheit in Alanin konnte jedoch gezeigt werden, dass diese Phosphorylierungsstellen nicht für die -adrenerge Modulation nötig sind (Lemke et al. 2008, Yang et al. 2013, Katchman et al. 2017, Ahern und Satin 2019). Auch die Phosphorylierung der 2-Untereinheit scheint keine Rolle im Rahmen der -adrener- gen Stimulation zu spielen (Brandmayr et al. 2012). Genauso konnte die Interaktion der 1C-Untereinheit mit ihrem geschnittenen distalen C-Terminus diesbezüglich aus- geschlossen werden (Oz et al. 2017). Vielmehr zeigte sich, dass die Interaktion der 2- Untereinheit mit der 1C-Untereinheit für die PKA-vermittelte Modulation des LTCC nö- tig ist (Yang et al. 2019). Übereinstimmend hiermit wurde kürzlich der folgende Mechanismus vorgeschlagen: Im basalen Zustand inhibiert das regulatorische Protein Rad den LTCC durch Interak- tion mit der 2-Untereinheit. Durch PKA-vermittelte Phosphorylierung diffundiert Rad von der 2-Untereinheit, wodurch die Hemmung des Kanals wegfällt und verstärkte Kalziumströme möglich werden (Liu et al. 2020b). Die Rolle einer subzellulären Lokalisation der PKA in der Nähe des LTCC durch A- Kinase Ankerproteine ist ebenfalls unklar (Pallien und Klussmann 2020). Einerseits konnte gezeigt werden, dass eine Interaktion von AKAP15 und AKAP79 mit dem C- Terminus der 1C-Untereinheit Einfluss auf die Modulation des L-Typ Kalziumstroms hat (Gao et al. 1997, Hulme et al. 2003). Andererseits zeigte eine Mauslinie mit Knock- Out von AKAP15 kein verändertes Ansprechen des LTCC auf -adrenerge Stimulation (Jones et al. 2012).
Einleitung 14 Eine neuere Arbeit konnte zeigen, dass CaV 1.2 Komplexe in Endosomen intrazellulär gelagert werden k nnen und es durch PKA-vermittelte Stimulation kurzfristig zu ei- nem vermehrten Einbau von L-Typ Kalziumkanälen in die Zellmembran und somit er- höhten Kalziumströmen kommt (Ito et al. 2019, Westhoff und Dixon 2021). Letztlich jedoch ist der genaue Mechanismus, durch welchen die PKA die Aktivität des L-Typ Kalziumkanals erhöhen kann, nicht abschließend geklärt. Auch der Einfluss der verschiedenen regulatorischen und katalytischen Untereinheiten der PKA bleibt zu be- werten (Pallien und Klussmann 2020). 1.4 Die elektromechanische Kopplung Im Rahmen eines Aktionspotentials einer Herzmuskelzelle führt die elektrische Erre- gung der Zelle zu einer mechanischen Kontraktion. Dieser Zusammenhang wird als elektromechanische Kopplung (ECC, excitation-contraction coupling) bezeichnet. Durch Depolarisation der Zelle während des Aktionspotentials kommt es zur Aktivie- rung von L-Typ Kalziumkanälen. Diese sind hauptsächlich in den transversalen Tubuli (T-Tubuli) lokalisiert (Bhargava et al. 2013). Hierbei handelt es sich um Einstülpungen der Zellmembran, welche die Zelle in regelmäßigen Abständen durchziehen (Jayasinghe et al. 2009). Die T-Tubuli sind in unmittelbarer Nähe zum sarkoplasmati- schen Retikulum (SR), dem intrazellulären Kalziumspeicher, lokalisiert und bilden mit ihm sogenannte Dyaden aus. Durch die Öffnung der L-Typ Kalziumkanäle kommt es im Bereich der Dyade zur Erhöhung der intrazellulären Kalziumkonzentration und Ak- tivierung von kalziumabhängigen Kalziumkanälen des SR, den Ryanodin-2 Rezepto- ren (RyR2). Hierdurch wird der Hauptteil des für die Kontraktion nötigen Kalzium aus dem SR ins Zytosol freigesetzt. Diese Kalzium-induzierte Kalziumfreisetzung (CICR, calcium-induced-calcium-release) ermöglicht eine koordinierte und massive Erhöhung der globalen, zytoplasmatischen Kalziumkonzentration. Durch die Bindung von Ca2+ an Troponin C kommt es zu einer Konformationsänderung des Troponin-Tropomyosin- Komplexes, Aktivierung des Querbrückenzyklus und Auslösung der Kontraktion (Bers 2002, Schrader et al. 2014). Die Relaxation der Muskelzelle wird durch die Senkung der intrazellulären Kalziumkonzentration und Beendigung des Querbrückenzyklus ein- geleitet. Der Großteil des Kalziums wird über die Kalziumpumpe des sarkoplasmati- schen Retikulums (SERCA) zurück ins SR transportiert. Ein kleinerer Teil verlässt die
Einleitung 15 Zelle über den Natrium-Kalzium-Austauscher (NCX) nach extrazellulär. Marginal wird Kalzium auch über eine membranständige Kalziumpumpe nach extrazellulär und über einen Kalzium-Uniporter in die Mitochondrien befördert (Bers 2008). Abbildung 3: E e ec a c eK g d -adrenerge Signaltransduktion in Herzmuskelzellen Die in den T-Tubuli lokalisierten L-Typ Kalziumkanäle vermitteln während des Aktionspotentials die Kalzium-indu- zierte Kalziumfreisetzung aus dem SR und lösen somit die Kontraktion der Zelle aus. Durch -adrenerge Stimula- tion kommt es zur cAMP-vermittelten Aktivierung der PKA. Diese phosphoryliert Proteine der elektromechani- schen Kopplung sowie des Sarkomers und beeinflusst so die kontraktilen Eigenschaften der Zelle. Durch Phos- phorylierung von nukleären Transkriptionsfaktoren wie CREB, wird die Genexpression und das Zellwachstum re- guliert. Die PKA-vermittelte Phosphorylierung von 1-Rezeptoren führt zur Entkopplung von deren G-Protein und zur Desensibilisierung gegenüber Liganden. AC: Adenylylcyclase, 1-AR: 1-Adrenorezeptor, C: katalytische PKA-Untereinheit, CREB: cAMP-response-element-binding-protein, LTCC: L-Typ Kalziumkanal, NCX: Natrium- Kalzium-Austauscher, PKA: Proteinkinase A, PLB: Phospholamban, R: regulatorische PKA-Untereinheit, RyR2: Ryanodin-2 Rezeptor, SERCA: Kalziumpumpe des sarkoplasmatischen Retikulums, SR: sarkoplasmatisches Re- tikulum. Angelehnt an Bers (2002) und Bodi et al. (2005). Abbildung erstellt mit BioRender.com Um die Kontraktionskraft und -geschwindigkeit an die benötigte Herzleistung anpas- sen zu können, unterliegen die Mechanismen der elektromechanischen Kopplung der Regulation des autonomen Nervensystems. Hierbei spielen PKA-vermittelte Phospho- rylierungen eine entscheidende Rolle. Durch die Phosphorylierung des LTCC-Kanal- komplexes und des RyR2 werden deren Öffnungswahrscheinlichkeiten erhöht und der
Einleitung 16 Kalziumeinstrom verstärkt, was eine positive Inotropie zur Folge hat (Marx et al. 2000, Kumari et al. 2018). Insbesondere die PKA-vermittelte Modulation des LTCC ist für die Vermittlung der positiven Inotropie verantwortlich (Yang et al. 2019). Durch Phospho- rylierung von Phospholamban (PLB), dem Regulatorprotein der SERCA, wird deren Aktivität gesteigert und Kalzium schneller ins SR zurücktransportiert, was die Relaxa- tion beschleunigt und das SR für die nächste Kontraktion mit mehr Kalzium belädt (Li et al. 2000, Kranias und Hajjar 2012). Die positive Lusitropie wird durch Phosphorylie- rung der Strukturproteine Troponin I und Myosin-bindendes Protein C3, welche im phosphorylierten Zustand die Interaktion der kontraktilen Proteine reduzieren, unter- stützt (Sadayappan und de Tombe 2012, Rao et al. 2014). 1.5 Pathophysiologische Aspekte 1.5.1 Herzhypertrophie Anhaltende Druck- und/oder Volumenbelastungen führen zu kompensatorischen An- passungsreaktionen des Herzens. Das Myokard reagiert auf eine chronische Belas- tung mit einer Größenzunahme der Kardiomyozyten und der Wanddicke sowie Anpas- sung der kontraktilen Prozesse, um die druck- oder volumenbedingt erhöhte Wand- spannung zu senken (Nakamura und Sadoshima 2018). Es kann zwischen physiolo- gischer und pathologischer Herzhypertrophie unterschieden werden. Erstere entsteht als reversible Reaktion auf physiologische Stimuli wie körperliches Training oder wäh- rend des Wachstums. Sie zeigt in der Regel eine erhöhte Kontraktilität ohne patholo- gische Veränderungen des Myokards. (Shimizu und Minamino 2016). Die pathologische Herzhypertrophie hingegen entwickelt sich als Anpassungsreaktion auf krankhafte Veränderungen des kardiovaskulären Systems wie z.B. arterielle Hy- pertonie, ischämische Kardiomyopathie, Herzklappenfehler oder Herzrhythmusstörun- gen (Heineke und Molkentin 2006). Die hierdurch reduzierte Auswurfleistung führt zur Aktivierung von verschiedenen Gegenmechanismen, allen voran des Sympathikus und des Renin-Angiotensin-Aldosteron-Systems (RAAS), mit dem Ziel die Pumpleis- tung des Herzens aufrecht zu erhalten (Lymperopoulos et al. 2013, Schrader et al. 2014). Kurzfristig kann dies auch erreicht werden. Langfristig führen diese neurohu- moralen Reaktionen jedoch zu pathologischen Veränderungen im Herzen. Die
Einleitung 17 Reexpression von fetalen Genen, erhöhte Apoptose, gestörtes Kalziumhandling, Ver- änderung von Signalwegen und der elektromechanischen Kopplung führen zu einer verminderten Pumpfunktion und gehen so in das Krankheitsbild der Herzinsuffizienz über (Braunwald 2013, Shimizu und Minamino 2016, Nakamura und Sadoshima 2018). 1.5.2 -adrenerges Signaling im hypertrophen Herz Eine anhaltende Stimulation des Herzens durch das adrenerge System trägt maßgeb- lich zur Entstehung der Herzhypertrophie bei (Morisco et al. 2001, Cotecchia et al. 2015). So können bei Patienten mit pathologischer Herzhypertrophie und Herzinsuffi- zienz bis zu 50-fach erhöhte Noradrenalinspiegel nachgewiesen werden (Lymperopoulos et al. 2013). Dauerhaft erhöhte Katecholaminspiegel führen zu weit- reichenden Ver nderungen innerhalb des -adrenergen Signalwegs. Die Phosphory- lierung des C-Terminus der -Rezeptoren durch die PKA oder G-Protein-gekoppelte Rezeptorkinasen (GRKs) führt zur Entkopplung der Rezeptoren von ihrem jeweiligen G-Protein und damit Desensibilisierung gegenüber Katecholaminen (Wang et al. 2018, Pfleger et al. 2019). Die PKA-vermittelte Phosphorylierung ist außerdem daran betei- ligt, dass der 2-Rezeptor vermehrt mit G i-Proteinen interagiert und somit keine posi- tiv inotrope Wirkung mehr entfalten kann (Daaka et al. 1997, Xiao 2001). Zusätzlich ändert sich die Lokalisation und das Expressionsmuster der Rezeptoren. W hrend 2-Rezeptoren in gesunden Kardiomyozyten ausschließlich in den T-Tubuli lokalisiert sind, werden sie bei pathologisch veränderten Herzmuskelzellen auch an der Zelloberfläche exprimiert, wodurch die räumliche Strukturierung von Signalwegen gestört wird (Nikolaev et al. 2010). Durch die GRK-vermittelte Phosphorylierung kommt es neben der Desensibilisierung auch zur Downregulation der 1-Rezeptoren (Bristow et al. 1986, Kudej et al. 1997, Pfleger et al. 2019). Die Expression der 2-Rezeptoren ändert sich nicht, wodurch sich das Verhältnis von 1: 2-Rezeptoren von 80:20 auf 50:50 verschiebt (Ungerer et al. 1993, Lymperopoulos et al. 2012). Die PKA hat hierbei vermutlich Einfluss auf die Aktivität der GRKs (Cong et al. 2001). Außerdem konnte ge eigt werden, dass die RI -vermittelte PKA-Aktivität vermutlich an der Downregula- tion des 1-Rezeptors beteiligt ist (Jamra 2018).
Einleitung 18 Diese Mechanismen sollen die kardiotoxischen Effekte der chronischen -adrenergen Stimulation abschwächen. Schlussendlich führt das abnorme -adrenerge Signaling durch vermindertes Ansprechen auf Katecholamine und gestörte Kontraktilität jedoch zu einem Verlust der funktionellen Reserve und trägt zur Progression der Herzinsuffi- zienz bei (Rockman et al. 2002, Rengo et al. 2009, Pfleger et al. 2019). 1.5.3 L-Typ Kalziumkanäle im hypertrophen Herz Pathologisch hypertrophe und insuffiziente Herzen zeigen sowohl beim Menschen als auch im entsprechenden Tiermodell Veränderungen der L-Typ Kalziumkanäle und de- ren elektrophysiologischen Eigenschaften, welche zu einem gestörten Kalziumhand- ling beitragen (Richard et al. 1998, Benitah et al. 2002). Kalziumströme von pathologisch veränderten Kardiomyozyten weisen eine Aktivierung bei negativeren Potentialen sowie eine langsamere Inaktivierung auf (Chen et al. 2002, Benitah et al. 2010). Als Korrelat der Hypertrophie können größere Kapazitäten ge- genüber gesunden Zellen gemessen werden. Die Stromstärke des L-Typ Kalzium- stroms zeigt sich in der Regel ebenfalls erhöht. Normalisiert auf die Kapazität ergeben sich jedoch unveränderte und sogar teilweise verringerte Stromdichten gegenüber ge- sunden Zellen (Mukherjee und Spinale 1998, Benitah et al. 2010, Kumari et al. 2018). Die erhöhte Stromstärke lässt sich auf eine erhöhte Offenwahrscheinlichkeit der durch die anhaltende -adrenerge Stimulation beraktiven Kanäle zurückführen, wobei ver- mutlich eine berexpression der 2-Untereinheit des LTCC eine Rolle spielt (Schroder et al. 1998, Chen et al. 2002, Hullin et al. 2007). Da aber trotz dieser vermehrten Akti- vität der LTCCs die Stromdichte der pathologischen Zellen unverändert bis verringert ist, geht man davon aus, dass sich insgesamt weniger aktive Kanäle in der Zellmemb- ran befinden (Chen et al. 2002, Benitah et al. 2010). Übereinstimmend mit dieser An- nahme kann in Kardiomyozyten insuffizienter Herzen eine Störung des T-tubulären Systems mit einhergehender gestörter Lokalisation sowie erhöhter Aktivität von L-Typ Kalziumkanälen festgestellt werden (Guo et al. 2013, Sanchez-Alonso et al. 2016). In pathologischer Herzhypertrophie und Herzinsuffizienz ist außerdem der Einbau von LTCCs in die Zellmembran gestört, was zu einer verringerten Anzahl an funktionsfähi- gen Kanälen in der Membran führt und die veränderten elektrophysiologischen Para- meter erklären kann (Hong et al. 2012, Westhoff und Dixon 2021).
Einleitung 19 1.6 Ziele dieser Arbeit Im Rahmen der Sympathikus-vermittelten, -adrenergen Stressreaktion ist die Protein- kinase A ein zentrales Element der Signaltransduktion im Herzen (Liu et al. 2021). Trotz ihrer prominenten Stellung sind bezüglich der genauen Funktionen der kardialen PKA in Physiologie und Pathophysiologie immer noch Fragen offen. Insbesondere der genaue Einfluss der PKA auf kardiale L-Typ Kalziumkanäle nach -adrenerger Stimu- lation ist nicht abschließend geklärt (Katchman et al. 2017, Ahern und Satin 2019, Pallien und Klussmann 2020). In dieser Arbeit sollen die Einflüsse der durch die RI -Untereinheit vermittelten PKA- Aktivität auf kardiale L-Typ Kalziumkanäle sowohl unter physiologischen Bedingungen als auch in pharmakologisch induzierter Herzhypertrophie analysiert werden. Hier u soll eine transgene Mauslinie (RI B x -MHC-CreERT2) verwendet werden, welche herzspezifisch eine zeitlich kontrolliert induzierbare Mutation der regulatori- schen PKA-Untereinheit RI exprimiert. Die Gesamtaktivit t der PKA ist in dieser Mauslinie um ca. 43 % reduziert (Jamra 2018). Zur Induktion eines kardial hypertro- phen Phänotyps wird eine langanhaltende pharmakologische Stimulation des adrener- gen Systems herangezogen. Durch die Messung von Kalziumströmen linksventrikulä- rer Kardiomyozyten mit der Patch-Clamp-Technik sollen L-Typ Kalziumkanäle elektro- physiologisch untersucht und so ihre PKA-vermittelte Modulation analysiert werden.
Material und Methoden 20 2 Material und Methoden 2.1 Maus-Genotypisierung Zur Genotypisierung wurde genomische DNA aus einem Schwanzspitzenbiopsat der Mäuse isoliert und mittels Polymerase-Kettenreaktion vervielfältigt. Anschließend er- folgte die Auftrennung und Charakterisierung der amplifizierten DNA mittels Agarose- Gelelektrophorese. 2.1.1 Isolation von genomischer DNA Zur DNA-Isolation wurde den neugeborenen Versuchsmäusen eine ca. 1 mm lange Schwanzspitzenbiopsie entnommen. Diese wurde in 100 µl Lysepuffer überführt und über Nacht bei 56 °C und 800 rpm in einem Temperier- und Mischgerät (Thermomixer Compact, Eppendorf) verdaut. Die im Lysepuffer enthaltene Proteinase K wurde am nächsten Tag durch 15-minütiges Erhitzen auf 95 °C inaktiviert. 2.1.1.1 Puffer Lysepuffer Volumen: 100 µl je Biopsat Reagenz Hersteller Konzentration Volumen Endkonzentra- tion Proteinase K Roth 20 mg/ml 2 µl 0,4 mg/ml 10 x PCR-Puffer 10 x 10 µl 1x H2O 88 µl 10 x PCR-Puffer Volumen: 100 ml, pH 9,0, 10-fache Konzentration Reagenz Hersteller Molare Masse Einwaage Endkonzentra- tion Tris-HCl Roth 157,60 g/mol 1,580 g 100 mM MgCl2 x 6 H2O Sigma 203,30 g/mol 0,304 g 15 mM KCl Merck 74,56 g/mol 3,730 g 500 mM
Material und Methoden 21 2.1.2 Polymerase-Kettenreaktion Mit der Polymerase-Kettenreaktion (PCR, polymerase-chain-reaction) können auch geringe Mengen an Nukleinsäure in-vitro amplifiziert werden (Mullis und Faloona 1987, Saiki et al. 1988). In einem zyklischen Prozess wird eine gewünschte DNA-Sequenz durch enzymatische Verlängerung von Oligonukleotid-Primern vervielfältigt. Zunächst wird die zu amplifizierende, doppelsträngige DNA durch Erhitzen auf 94 °C denaturiert. Hierbei öffnen sich die Wasserstoffbrückenbindungen zwischen den Einzelsträngen der DNA (Denaturierung). Danach wird die Temperatur abgesenkt und die beiden spe- zifischen Primer können an die Einzelstränge binden (Annealing). Die Primer sind Oli- gonukleotide, welche komplementär zu den Anfangssequenzen der zu amplifizieren- den DNA sind. Mit ihrem freien 3 -OH-Ende bilden die Primer den Startpunkt zur Kettenverlängerung durch die temperaturstabile DNA-Polymerase. Diese synthetisiert im nächsten Schritt den jeweils komplementären Strang zum vorliegenden Einzel- strang in 5 3 -Richtung (Elongation). Die so gewonnene doppelsträngige DNA wird wieder aufgeschmolzen und nach Binden der Primer erneut amplifiziert. Mit jedem Zyklus der PCR kommt es, im Idealfall, zu einer Verdoppelung der gewünschten DNA- Sequenz. Nach n Zyklen liegen somit bis zu 2n Amplifikate vor. 2.1.2.1 Primer Die verwendeten Primer wurden von Eurofins Genomics bezogen. Die lyophilisierten Primer wurden mit DNase-freiem Wasser auf eine Konzentration von 100 µmol/l gelöst. Ausgehend von dieser Stock-Lösung wurden Arbeitslösungen mit einer Konzentration von 10 µmol/l hergestellt. Die Primersequenzen sind im Folgenden angegeben: Primer Primersequen von 5 nach 3 Prk_SH_f (rev) CGC TTG AGG ATG TCT GAG CAC Prk1a_Intr_f TAT CAT GTC TGG ATC CGC G MHCCre_f CTT ACC CCA CAT AGA CCT CTG ACA MHCCre_r TGC TGT TGG ATG GTC TTC ACA G
Material und Methoden 22 2.1.2.2 Durchführung Zur Amplifikation der genomischen DNA wurde der Roti®-Pol TaqS Red-Mix (2x) der Firma Roth verwendet. Dieser PCR-Mix enthält eine rekombinante Taq-DNA-Poly- merase, Desoxyribonukleosid-Triphosphate (dNTP, zu je 0,4 mM), MgCl2 (4 mM) und Kresolrot (0,02 %) als anionischen Farbstoff (Loading Dye). Hieraus wurde folgender Reaktionsansatz hergestellt: Primer 1 0,25 µl Primer 2 0,25 µl PCR-Mix 5 µl DNA-Template 1 µl H2O ad 10 µl Die PCR wurde in einem Thermocycler Biometra TAdvanced (Analytik Jena) mit fol- gendem Programm durchgeführt: 94 °C 3 min 94 °C 30 s 63 °C 30 s 40x 72 °C 30 s 72 °C 5 min 2.1.3 Agarose-Gelelektrophorese Die Agarose-Gelelektrophorese ist ein Verfahren zur Auftrennung und Charakterisie- rung von Nukleinsäuren (Heinrich et al. 2014). Hierbei macht man sich die Wande- rungseigenschaften der Nukleinsäurestränge in einem elektrischen Feld zunutze. DNA- und RNA-Stränge sind aufgrund ihres Zucker-Phosphat-Gerüsts negativ gela- den und wandern daher zum positiv geladenen Pol eines elektrischen Feldes (Anode). Die mittels PCR amplifizierten Nukleinsäurestränge werden in eine Agarose-Gelmatrix eingebracht, an welche eine elektrische Spannung angelegt wird. Je größer die Nuk- leinsäuremoleküle sind, desto langsamer wandern sie durch die Agarose-Gelmatrix und umgekehrt. Ein anionischer Farbstoff (Loading Dye) im Probepuffer markiert die
Material und Methoden 23 Lauffront und ermöglicht somit eine Sichtkontrolle der Elektrophorese. Durch Zugabe von DNA-bindenden Farbstoffen werden die aufgetrennten DNA-Fragmente als dis- krete Banden dargestellt. Das Wanderungsverhalten einer bekannten DNA-Probe (DNA-Leiter) dient als Maßstab und ermöglicht die Abschätzung der Größe der zu cha- rakterisierenden Banden. 2.1.3.1 Durchführung Für die Elektrophorese wurde 2 %iges Agarosegel hergestellt. Das Agarosepulver (peqGOLD Universal Agarose, peqlab) wurde mit Elektrophoresepuffer (1xTAE) in ei- nem Mikrowellenherd erhitzt und anschließend unter ständigem Rühren abgekühlt. Zu dem Gel wurden 5 µL 1 %ige Ethidiumbromid-Lösung pipettiert. Dieser Fluoreszenz- farbstoff bindet an die DNA-Fragmente und macht diese unter UV-Licht bei 302 nm sichtbar. Das Gel wurde in eine horizontale Elektrophoresekammer gegossen. Diese wurde nach Festwerden des Gels mit Elektrophoresepuffer gefüllt. Die elektrophoreti- sche Auftrennung der DNA erfolgte über 45 min bei 120 Volt. Mit einem UV-Transillu- minator (Gel Doc 2000, Bio-Rad) wurden die DNA-Banden in der Gelplatte detektiert und zur Analyse digitalisiert. Transgene Tiere des in dieser Arbeit verwendeten Maus- modells zeigen gegenüber Wildtyp-Tieren eine zusätzliche Bande (siehe Abbildung 4). Abbildung 4: Genotypisierung der RI B -MHC-CreERT2 Mauslinie Digitalisierte Abbildung der aufgetrennten genomischen DNA im Agarosegel. Die linke Säule zeigt die DNA-Leiter als Maßstab. tg: transgen, wt: Wildtyp.
Sie können auch lesen