Herzlich Willkommen Start des Webinars um 18:00 Uhr - AHOP
←
→
Transkription von Seiteninhalten
Wenn Ihr Browser die Seite nicht korrekt rendert, bitte, lesen Sie den Inhalt der Seite unten
Programm
Nutzen Sie
die anonyme
Begrüßung Chatfunktion für
Ihre Fragen!
DGKP Harald Titzer, BSc, MSc, AHOP Präsident
Fakten und Highlights zu DARZALEX®
Mag. Klara Mayer, Product Manager Multiples Myelom – Janssen
Subkutane Applikation von DARZALEX®
DGKP Silke Gruber, MSc, Schule für Gesundheits- und Krankenpflege – Campus Ottakring, Klinik Ottakring, Gesundheitsverbund
Zusammenfassung und weitere Fragen
Mag. Klara Mayer, Product Manager Multiples Myelom – Janssen
DGKP Harald Titzer, BSc, MSc, AHOP Präsident
Abschluss
DGKP Harald Titzer, BSc, MSc, AHOP Präsident
AT_ CP-164022_22Jun2020Fakten und Highlights zu
DARZALEX ®
Mag. Klara Mayer
Product Manager Multiples Myelom – Janssen
AT_ CP-164022_22Jun2020DARZALEX® Injektionslösung zur subkutanen Gabe1
• Applikation innerhalb von 3-5 Minuten
• Fixdosierung von 1.800 mg
• Verabreichung ab der ersten Gabe
• Umstellung von Patienten, die DARZALEX® bereits als intravenöse
Gabe erhalten
• Bei allen zugelassenen Indikationen einsetzbar
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020
AT_ CP-164022_22Jun2020Überblick zugelassener Therapien im Multiplen Myelom#1–9
D DARZALEX® (Daratumumab)
d Dexamethason
E Empliciti® (Elotuzumab)
I Ninlaro® (Ixazomib)
Isa Sarclisa® (Isatuximab)
K Kyprolis® (Carfilzomib)
M Melphalan
P Prednison
PLd CAELYX® (peg. Liposomales
Doxorubicin)
Pano Farydak® (Panobinostat)
Pom Imnovid® (Pomalidomid)
R Revlimid® (Lenalidomid)
T Thalidomid
V VELCADE® (Bortezomib)
# Zugelassene Therapien Stand Juni 2020. Kein Anspruch auf Vollständigkeit. Bitte beachten Sie die vollständigen Anwendungsgebiete der Arzneimittel in der jeweiligen Fachinformation.
1. Fachinformation DARZALEX® 1.800mg Injektionslösung Juni 2020, 2. VELCADE ® Fachinformation Februar 2020, 3. Fachinformation Revlimid ® (Jän 2020) unter:
http://www.ema.europa.eu/ (aufgerufen am 27.1.2020), 4. Fachinformation Kyprolis ® (Jän 2020) unter: http://www.ema.europa.eu/ (aufgerufen am 27.1.2020), 5. Fachinformation
Farydak ® (Dez 2019) unter: http://www.ema.europa.eu/ (aufgerufen am 27.1.2020), 6. Fachinformation Imnovid ® (Juni 2019) unter: http://www.ema.europa.eu/ (aufgerufen am
27.1.2020), 7. Fachinformation Empliciti® (Nov 2019) unter: http://www.ema.europa.eu/ (aufgerufen am 27.1.2020), 8. Fachinformation Ninlaro® (Okt 2019) unter:
AT_ CP-164022_22Jun2020
http://www.ema.europa.eu/ (aufgerufen am 27.1.2020), 9. Fachinformation Sarclisa® (Juni 2020) unter unter: http://www.ema.europa.eu/ (aufgerufen am 16.6.2020)Relevante Unterschiede
DARZALEX Injektionslösung SC1 DARZALEX Infusionslösung IV2
Dosierung 1.800 mg (Fixdosierung) 16 mg/kg
Größe 15 ml Durchstechflasche 100 mg / 400 mg Durchstechflasche
(120 mg Daratumumab pro ml) (20 mg Daratumumab pro ml)
Zusammensetzung Injektionslösung (gebrauchsfertig) Konzentrat zur Herstellung einer
Infusionslösung
Applikation Subkutane Injektion oder Intravenöse Infusion über ein
Infusion über subkutanes Infusionsset Infusionsset
Dauer der Applikation 3-5 Minuten 1. Infusion: median 7 Stunden
(Split auf 2 Tage möglich)
2. Infusion: median 4 Stunden
3.+ Infusion: median 3 Stunden
Häufigkeit infusionsbedingter* Reaktionen 11 % (3,7 Stunden) 39 % (1,5 Stunden)
(Mediane Zeit bis zum Auftreten)
* Infusionsbedingte Reaktion schließt Begriffe ein, die von Prüfärzten als mit der Infusion/Injektion von Daratumumab im Zusammenhang stehend definiert wurden.
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020; 2. Fachinformation DARZALEX® 20mg Infusionslösung März 2020 AT_ CP-164022_22Jun2020Wesentliche Parallelen
Studien haben die DARZALEX Injektionslösung SC1 DARZALEX Infusionslösung IV2
Nicht-Unterlegenheit der Indikationen und Kombinationen
subkutanen vs. der intravenösen Dosierschemata
Verabreichung bestätigt1,2
Effektivität
Sicherheitsprofil
Infusionsbedingte* Reaktionen meist bei Erstgabe (Grad 1-2)
Prä- und Postmedikation
Herpes-Zoster-Prophylaxe
* Infusionsbedingte Reaktion schließt Begriffe ein, die von Prüfärzten als mit der Infusion/Injektion von Daratumumab im Zusammenhang stehend definiert wurden.
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020; 2. Fachinformation DARZALEX® 20mg Infusionslösung März 2020 AT_ CP-164022_22Jun2020Wichtigste Vorteile
Verkürzte Applikationszeit auf
3-5 Minuten1,2
Vereinfachtes
Patientenmanagement1,2
Verkürzte Prozesse führen zu
freigespielten Ressourcen in
Patienten bevorzugen die der Klinik1,2
subkutane Gabe1,3
Um 2/3 weniger
infusionsbedingte* Reaktionen1,2
* Infusionsbedingte Reaktion schließt Begriffe ein, die von Prüfärzten als mit der Infusion/Injektion von Daratumumab im Zusammenhang stehend definiert wurden.
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020; 2. Mateos MV, et al. Subcutaneous versus intravenous daratumumab in patients with relapsed or refractory multiple
myeloma (COLUMBA): a multicentre, open-label, non-inferiority, randomised, phase 3 trial. Lancet Haematol 2020; 7(5):e370–e380; 3. Usmani S, et al. Randomized, Open-label, Non-
inferiority, Phase 3 Study of Subcutaneous (SC) Versus Intravenous (IV) Daratumumab (DARA) Administration in Patients With Relapsed or Refractory Multiple Myeloma: COLUMBA
Update. ASH 2019, Orlando, Poster 1865Subkutane Applikation von
DARZALEX ®
DGKP Silke Gruber, MSc
Schule für Gesundheits- und Krankenpflege – Campus
Ottakring, Klinik Ottakring, Gesundheitsverbund
AT_ CP-164022_22Jun2020Tipps zur SC-Gabe aus der Praxis
• Patient*innenidentifikation
• Kontrolle der Verabreichungsform
• geeignete SC-Nadel verwenden
• Patient*in über mögliche IRR informieren
• bequeme Position für Patient*in und Pflegeperson (Rückenschonendes Arbeiten)
• während der Applikation Patient*in beobachten
• Applikationszeit dokumentieren
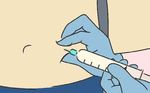
AT_ CP-164022_22Jun2020Anwendung der DARZALEX® Injektionslösung
Applikation über1
• Injektionsnadel zur subkutanen Verabreichung
• Infusionsset zur subkutanen Verabreichung
Video zur Demonstration
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020
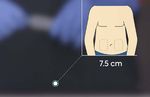
AT_ CP-164022_22Jun2020Wichtigste Schritte im Überblick1
1 2 3 4
7,5 cm links oder oder 3-5 Minuten Reaktionen an der
rechts des Einstichstelle bei ca. 8%
Bauchnabels der Patienten beobachtet
(ausschl. Grad 1-2, meist
Erytheme, Verhärtung,
Juckreiz)
Abbildungen erstellt nach Ref. 1
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020
AT_ CP-164022_22Jun2020Infusionsbedingte* Reaktionen (IRR)1 • In Studien bei ca. 11% der Patienten aufgetreten, Ausprägung meist Grad 1-2 und bei Erstgabe (IRR Grad 3: ca. 1%; Grad 4: 0%; Inzidenz bei nachfolgenden Injektionen bei < 1% der Patienten) • Mediane Zeit bis zum Auftreten nach 3,7 Stunden am Behandlungstag (Auftreten verzögerter IRRs bei < 1% der Patienten) • Symptome: Atemwegssymptome wie verstopfte Nase, Husten, Rachenreizung, allergische Rhinitis, keuchende Atmung sowie Pyrexie, Schmerzen im Brustraum, Juckreiz, Schüttelfrost, Erbrechen, Übelkeit und Hypotonie • Schwere IRRs: Bronchospasmus, Hypoxie, Dyspnoe, Hypertonie und Tachykardie • Eine Prä- und Postmedikation soll vor und nach der Injektion verabreicht werden, um das Risiko von IRRs zu reduzieren * Infusionsbedingte Reaktion schließt Begriffe ein, die von Prüfärzten als mit der Infusion/Injektion von Daratumumab im Zusammenhang stehend definiert wurden. 1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020 AT_ CP-164022_22Jun2020
Empfohlene Prä- und Postmedikation1
1-3 Stunden vor subkutaner Injektion Nach subkutaner Injektion
(oral oder intravenös) (oral)
• Antihistaminikum • Kortikoid
25-50 mg Diphenhydramin oder Äquivalent Monotherapie: 20 mg Methylprednisolon oder
Äquivalent (am 1. und 2. Tag nach jeder Injektion)
• Antipyretika Kombinationstherapie: ≤20 mg Methylprednisolon
650-1.000 mg Paracetamol oder Äquivalent (am 1. Tag nach jeder Injektion;
wenn Teil des Hintergrundregimes, kein zusätzliches
• Kortikoid Kortikoid verabreichen)
Monotherapie: 100 mg Methylprednisolon oder
Äquivalent (kann nach der 2. Injektion auf 60 mg Die Postmedikation kann abgesetzt werden, wenn nach
reduziert werden) den ersten 3 Injektionen keine schweren IRR
Kombinationstherapie: 20 mg Dexamethason oder aufgetreten sind (ausgenommen Kortikosteroide des
Äquivalent (wenn Teil des Hintergrundregimes, kein Hintergrundregimes).
zusätzliches Kortikoid verabreichen)
Bei Patienten mit COPD kurz und lang wirksame
Bronchodilatatoren und inhalative Kortikoide in
Erwägung ziehen.
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020
AT_ CP-164022_22Jun2020Hinweise und Empfehlungen zur Kommunikation
Stabilität der Dauer der Aufklärung zu Reaktionen
vorbereiteten Spritze Nachbeobachtungszeit an der Einstichstelle und
von 4 Stunden bei im Ermessen des Arztes2 (verzögerten) IRR
Raumtemperatur (≤30 °C) insbesondere bei Erstgabe1
und bei Raumlicht1
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020; 2. Mateos MV, et al. Subcutaneous versus intravenous daratumumab in patients with relapsed or refractory multiple
myeloma (COLUMBA): a multicentre, open-label, non-inferiority, randomised, phase 3 trial. Lancet Haematol 2020; 7(5):e370–e380; 3. Usmani S, et al. Randomized, Open-label, Non-
inferiority, Phase 3 Study of Subcutaneous (SC) Versus Intravenous (IV) Daratumumab (DARA) Administration in Patients With Relapsed or Refractory Multiple Myeloma: COLUMBA AT_ CP-164022_22Jun2020
Update. ASH 2019, Orlando, Poster 1865Zusammenfassung
und weitere Fragen
Mag. Klara Mayer
Product Manager Multiples Myelom – Janssen
DGKP Harald Titzer, BSc, MSc
AHOP Präsident
AT_ CP-164022_22Jun2020Bei welchen Patienten kann DARZALEX®
als Injektionslösung zur subkutanen Gabe
eingesetzt werden?
AT_ CP-164022_22Jun2020Einsatz von DARZALEX® Injektionslösung
zur subkutanen Gabe1
• Bei allen zugelassenen Indikationen
einsetzbar
• Verabreichung ab der ersten Gabe bei neu
diagnostizierten Multiples Myelom
Patienten
• Umstellung von Patienten, die
DARZALEX® bereits als intravenöse Gabe
erhalten
Legende und Referenzen siehe voriges Slide
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020
AT_ CP-164022_22Jun2020Ist die subkutane und intravenöse
Formulierung als gleichwertig anzusehen?
AT_ CP-164022_22Jun2020Daten aus der COLUMBA-Studie (Monotherapie ≥3. Linie)1
Ansprechraten und Verträglichkeitsprofil sind vergleichbar Abbrüche aufgrund therapiebedingter NW
DARA IV: 8% DARA SC: 7%
Therapiebedingte NW Grad ≥3
DARA IV: 49% DARA SC: 46%
Therapiebedingte NW Grad 5
DARA IV: 7% DARA SC: 5%
IRR (meist Grad 1-2 bei Erstgabe)
DARA IV: 34,5% DARA SC: 12,7%
Neutropenie (alle Grade)
DARA IV: 14% DARA SC: 19%
1 Mateos MV, et al. Efficacy and Safety of the Randomized, Open-label, Non-inferiority, Phase 3 Study of Subcutaneous (SC) Versus Intravenous (IV) Daratumumab (DARA)
Administration in Patients With Relapsed or Refractory Multiple Myeloma (RRMM): COLUMBA. ASCO 2019, Chicago, Oral presentation Abstr. # 8005 AT_ CP-164022_22Jun2020Ist bei Patienten mit geringerem Gewicht eine
Dosisreduktion nötig?
AT_ CP-164022_22Jun2020Daten aus der COLUMBA-Studie (Monotherapie ≥3. Linie)1
Keine Dosisanpassung aufgrund des Gewichts aufgrund gleicher Wirkspiegel und Ansprechraten
Neutropenie (TEAE Grad 3-4) bei Pneumonie (TEAE Grad 3-4) über
≤65kg erhöht, was aber zu keiner alle Gewichtsgruppen leicht erhöht
höheren Infektionsrate führte im IV-Arm vs. SC-Arm (Bsp. ≤65 kg)
DARA IV: 9% DARA SC: 20% DARA IV: 5% DARA SC: 4%
TEAE: Therapiebedingte Nebenwirkungen (Treatment Emerged Adverse Events)
1 Mateos MV, et al. Randomized, Open-label, Non-inferiority, Phase 3 Study of Subcutaneous (SC) Versus Intravenous (IV) Daratumumab (DARA) Administration in Patients (Pts) With
Relapsed or Refractory Multiple Myeloma (RRMM): Body Weight Subgroup Analysis of COLUMBA. ASH 2019, Orlando, Abstr. # 1906 AT_ CP-164022_22Jun2020Was ist bei Lagerung und Zubereitung zu
bedenken?
AT_ CP-164022_22Jun2020Lagerung und Zubereitung1
1. Fachinformation DARZALEX® 1.800 mg Injektionslösung Juni 2020
AT_ CP-164022_22Jun2020Welche Unterlagen gibt es und wie bekomme
ich diese?
AT_ CP-164022_22Jun2020Weitere Informationen zu DARZALEX®
Bitte kontaktieren Sie Ihre/n
Janssen Ansprechpartner/in
oder alpmedinfo@its.jnj.com
AT_ CP-164022_22Jun2020Stellen Sie auch Ihre Fragen
Nutzen Sie
die anonyme
Chatfunktion für
Ihre Fragen!
AT_ CP-164022_22Jun20203 Fragen von uns an Sie
Punkteskala von 1 (niedrig) bis 10 (hoch)
• Wie gut wurden Ihnen die Inhalte dieses Webinars vermittelt?
• Wie praxisrelevant war dieses Webinar für Sie?
• Wie wahrscheinlich würden Sie dieses Webinar weiterempfehlen?
AT_ CP-164022_22Jun2020Aufzeichnung dieses Webinars unter www.ahop.at verfügbar
AT_ CP-164022_22Jun2020Danke für Ihre
Teilnahme
Wir wünschen einen schönen Abend!
AT_ CP-164022_22Jun2020Fachkurzinformation DARZALEX®
FACHKURZINFORMATION DARZALEX® 1.800 mg Injektionslösung:
Bezeichnung des Arzneimittels: DARZALEX 1.800 mg Injektionslösung Qualitative und quantitative Zusammensetzung: Jede 15 ml-Durchstechflasche mit Injektionslösung enthält 1.800 mg Daratumumab
(120 mg Daratumumab pro ml). Daratumumab ist ein humaner monoklonaler IgG1κ Antikörper gegen das CD38-Antigen, hergestellt in einer Säugetier-Zelllinie (Ovarzellen des chinesischen Hamsters [CHO])
durch rekombinante DNA Technologie. Sonstige Bestandteile: Jede 15 ml-Durchstechflasche mit Injektionslösung enthält 735,1 mg Sorbitol (E420), rekombinante humane Hyaluronidase (rHuPH20), Histidin,
Histidinhydrochlorid-Monohydrat, Methionin, Polysorbat 20, Sorbitol (Ph.Eur.) (E420), Wasser für Injektionszwecke. Anwendungsgebiete: DARZALEX ist indiziert in Kombination mit Lenalidomid und
Dexamethason oder Bortezomib, Melphalan und Prednison für die Behandlung erwachsener Patienten mit neu diagnostiziertem multiplen Myelom, die für eine autologe Stammzelltransplantation nicht geeignet
sind. DARZALEX ist indiziert in Kombination mit Bortezomib, Thalidomid und Dexamethason für die Behandlung erwachsener Patienten mit neu diagnostiziertem multiplen Myelom, die für eine autologe
Stammzelltransplantation geeignet sind. DARZALEX ist indiziert in Kombination mit Lenalidomid und Dexamethason oder Bortezomib und Dexamethason für die Behandlung erwachsener Patienten mit
multiplem Myelom, die bereits mindestens eine Therapie erhalten haben. DARZALEX ist indiziert als Monotherapie für die Behandlung erwachsener Patienten mit rezidiviertem und refraktärem multiplen Myelom,
die bereits mit einem Proteasom-Inhibitor und einem Immunmodulator behandelt wurden, und die während der letzten Therapie eine Krankheitsprogression zeigten.Gegenanzeigen: Überempfindlichkeit gegen
den Wirkstoff oder einen der genannten sonstigen Bestandteile. Inhaber der Zulassung: Janssen-Cilag International NV, Turnhoutseweg 30, B-2340, Beerse, Belgien. Vertrieb für Österreich: JANSSEN-
CILAG Pharma GmbH, Vorgartenstraße 206B, A-1020 Wien. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. ATCCode:L01XC24. Weitere Angaben
zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit sowie Nebenwirkungen
entnehmen Sie bitte der veröffentlichten Fachinformation. AT_CP-156634_v1.0_20200604
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Es ist daher wichtig, jeden Verdachtsfall einer Nebenwirkung in Bezug auf DARZALEX® zu melden.
FACHKURZINFORMATION DARZALEX® 20 mg Infusionslösung:
Bezeichnung des Arzneimittels: DARZALEX 20 mg/ml Konzentrat zur Herstellung einer Infusionslösung. Qualitative und quantitative Zusammensetzung: Jede 5 ml Durchstechflasche enthält 100 mg
Daratumumab (20 mg Daratumumab pro ml). Jede 20 ml Durchstechflasche enthält 400 mg Daratumumab (20 mg Daratumumab pro ml). Daratumumab ist ein humaner monoklonaler IgG1κAntikörper gegen das
CD38-Antigen, hergestellt in einer Säugetier-Zelllinie (Ovarzellen des chinesischen Hamsters [CHO]) durch rekombinante DNATechnologie. Sonstige Bestandteile: Jede 5 ml und 20 ml Durchstechflasche
DARZALEX enthält 0,4 mmol bzw. 1,6 mmol (9,3 mg bzw. 37,3 mg) Natrium. Essigsäure 99%, Mannitol (E421), Polysorbat 20, Natriumacetat-Trihydrat, Natriumchlorid, Wasser für Injektionszwecke.
Anwendungsgebiete: DARZALEX ist indiziert in Kombination mit Lenalidomid und Dexamethason oder Bortezomib, Melphalan und Prednison für die Behandlung erwachsener Patienten mit neu
diagnostiziertem multiplen Myelom, die für eine autologe Stammzelltransplantation nicht geeignet sind. DARZALEX ist indiziert in Kombination mit Bortezomib, Thalidomid und Dexamethason für die Behandlung
erwachsener Patienten mit neu diagnostiziertem multiplen Myelom, die für eine autologe Stammzelltransplantation geeignet sind. DARZALEX ist indiziert in Kombination mit Lenalidomid und Dexamethason oder
Bortezomib und Dexamethason für die Behandlung erwachsener Patienten mit multiplem Myelom, die bereits mindestens eine Therapie erhalten haben. DARZALEX ist indiziert als Monotherapie für die
Behandlung erwachsener Patienten mit rezidiviertem und refraktärem multiplen Myelom, die bereits mit einem Proteasom-Inhibitor und einem Immunmodulator behandelt wurden, und die während der letzten
Therapie eine Krankheitsprogression zeigten. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile. Inhaber der Zulassung: Janssen-Cilag International
NV, Turnhoutseweg 30, B-2340, Beerse, Belgien. Vertrieb für Österreich: JANSSEN-CILAG Pharma GmbH, Vorgartenstraße 206B, A-1020 Wien. Verschreibungspflicht/Apothekenpflicht: Rezept- und
apothekenpflichtig, wiederholte Abgabe verboten. ATC-Code: L01XC24. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und
sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit sowie Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. AT_CP-131704_v1.0_20200121
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Es ist daher wichtig, jeden Verdachtsfall einer Nebenwirkung in Bezug auf DARZALEX® zu melden.
AT_ CP-164022_22Jun2020Sie können auch lesen